Del 2: Proces og politik

Busting en myte
Jeg skulle faktisk bringe dette op i slutningen af del 1, men det går lige så godt her. Der findes en myte / rygte / sammensværgelse vedrørende mefloquine og CIA’s forsøg på at skabe en linje af super soldat ved hjælp af tankekontrol. Lad mig tale er dette lige nu.
Ligesom de fleste myter er der noget grundlag for dem i ægte livshændelser eller situationer. Det er bare, at du skal huske at forstå ting i deres rette perspektiv. Det er rigtigt, at mefloquine var et af de stoffer, der blev testet af CIA under sit MK Ultra-projekt. Der er dokumenteret beviser for dette, og det er jeg ikke i tvivl om. Det faktum, at regeringerne forpligter sig i tvivlsomme projekter som dette, bør komme som en overraskelse for ingen nu.
Men (og en stor dog ved det) er der mere, du skal overveje. For eksempel var mefloquine et af tusindvis af stoffer testet i dette program, og der var en god grund til at blive testet. Ligesom andre malariamedicin er mefloquin i en familie af stoffer kendt som quinoliner. En anden anti-malarial, chlorquin, er også en quinilon, og alle er derivater af kinin, det toksiske ekstrakt er først kendt for dets anti-malariale egenskaber.
Disse må ikke forveksles med quinoloner. I denne familie af stoffer er antibiotika, især fluoroquinoloner som ciprofloxacin. Disse lægemidler er også kendt for deres potentielle bivirkninger, og pleje skal bruges, når de tages. Selvom det ikke er kendt for at forårsage alvorlige psykiatriske problemer, kan fluorquinoloner forårsage reaktioner i centralnervesystemet, såsom hovedpine, svimmelhed eller søvnløshed.
Der er intet signifikant i, at mefloquine blev testet i dette program, som endte i 1973 forresten. Det blev testet, fordi andre lægemidler med en lignende form for det var kendt for at have sindsbevægende bivirkninger. For at være på den sikre side brugte jeg lidt tid på at undersøge sandsynligheden for, at der kunne være noget sandhed til rygten. Jeg kunne finde absolut ingen troværdige beviser, der ville overbevise mig om, at det ville berettige yderligere undersøgelse. Denne myte er bare det, en myte, og det er blevet busted.
Pharmaceuticals Business og Politik

I 1980’erne blev reguleringen af receptpligtige stoffer blevet et emne af stor diskussion i en række kredse. Der var et stigende opkald for at reducere den tid, det tog for lægemidler at ramme markedet, og en interessant blanding af parter gjorde dette opkald.
Naturligvis havde medicinalindustrien en interesse i dette. Med billioner af dollars på spil, jo hurtigere et firma kan bringe et nyt lægemiddel på markedet, jo hurtigere kan det begynde at genvinde udviklingsomkostningerne for det pågældende stof og forhåbentlig vinde før patentet på lægemidlet udløber. Lægemiddelvirksomheder bruger hvert år milliarder dollars til forskning og udvikling af nye terapier, så det er muligt at genvinde disse omkostninger for at sikre, at denne forskning kan fortsætte i fremtiden.
Inden for det medicinske samfund er der et ønske om at fjerne de bureaukratiske processer, der forsinker tilgængeligheden af potentielt livreddende stoffer. Mange læger har haft patienter, som ville have gavn af en ny behandling, der afventer godkendelse fra myndighederne. Det kan ofte være en lang og udtalt proces, og patienter kan dø ved at vente på et nyt lægemiddel til at passere sin vej gennem bureaukratiet.
Enhver læge vil formentlig fortælle dig, at de har konfronteret to eller to i deres karriere, og mange af deres patienter står over for samme voldsomme. En af de største vedrører medicin. Der er ikke noget som en “perfekt medicin”, hvert lægemiddel har bivirkninger. Problemet opstår, når bivirkningerne af medicinen slutter at være værre end den sygdom, den er beregnet til at behandle. Kræftpatienter på kemoterapi kan attestere til denne første hånd.
Det er noget, jeg også er alt for opmærksom på, min mor har været diagnosticeret med leddegigt i det forløbne år. Det blev anbefalet, at hun tager methotrexat, et lægemiddel, der også almindeligvis anvendes i kemoterapi-regimet af mennesker, der kæmper med forskellige former for kræft. I betragtning af afvejningen ser vi på andre alternativer, hvilket er, hvad mange mennesker ville gøre.
Når det kommer til mange forskere, er den ting, der normalt betyder mest, stoffets effektivitet. Kan det helbrede sygdommen effektivt inden for en bestemt periode. Når de tidlige resultater af et forsøg eller forsøg viser, at en forbindelse har evnen til at gøre, hvad det var meningen at gøre, og gør det godt, er der så et skub for at fortsætte med flere undersøgelser, der bekræfter resultaterne. At nogen kan blive skadet eller dø af forbindelsen, har ikke indgået ligningen på dette tidspunkt.
Efterhånden som yderligere undersøgelser er udført, overskrider graden af succes ved at kurere sygdommen ofte eventuelle potentielle bivirkninger, der kan opstå. Der kan være en tendens til at spille ned sådanne resultater som tilfældigt for at skildre resultaterne i et mere positivt lys.
1985: Et vigtigt år
Lariam blev godkendt til brug i Schweiz i 1985 af Interkantonale Kontrollstelle ftir Heilmittel (lKS), tilsynsorganet med ansvar for godkendelse af receptpligtige lægemidler i Schweiz på det tidspunkt. Et uddrag fra et papir udgivet i 1986 års årsberetning om folkesundhed lyder:
I Schweiz har IKS tilladelse til at vurdere nye terapeutiske midler inden markedsføring og at underrette kantinerne (kommunale enheder ansvarlige for sundhedsvæsenet) om sin vurdering af sammensætning, reklame og pris samt dens beslutning om godkendelse eller afslag på tilladelse til salg (20). Specifikke krav til registrering, herunder data om sikkerhed og virkning, er indeholdt i forskrifter formuleret i 1955, 1963 og 1972. Siden 1973 har IKS også fået beføjelse til at kontrollere fremstillingen af farmaceutiske midler. Det schweiziske system for lægemiddelgodkendelse er kendt for sin enkelhed og mangel på detaljerede specifikationer og krav. En schweizisk universitets farmakolog har bemærket, at det høje niveau af samarbejde mellem IKS og industrien er en bemærkelsesværdig egenskab
Ann. Rev. Folkesundhed. 1986. 7: 217-35 Copyright © 1986 af Annual Reviews Inc. Alle rettigheder forbeholdes
Samme år var også et vigtigt år for stoffet i USA. Det år anbefalede Food and Drug Administration, at mefloquine blev godkendt til brug i USA. FDA’s lægeofficer gjorde henstillingen var Dr. Celia Maxwell. Rapporter offentliggjort på det tidspunkt synes at tyde på, at Dr. Maxwell var meget begejstret for mefloquine, næsten til det punkt, der syntes at være en cheerleader for det.
Disse rapporter afslører også, at Dr. Maxwell på trods af den tilsyneladende opfattelse af mefloquine aldrig har taget stoffet selv og citerer “flere lægemiddelfølsomheder”. Hun har i øjeblikket stilling som associate dean of research ved Howard University i Washington D.C .. Jeg har sendt e-mails til Dr. Maxwell og spurgte, om hun ville være villig til at diskutere denne sag med mig, men hidtil har ikke modtaget noget svar. Jeg fortsætter med at prøve, og hvis jeg faktisk får svar, vil jeg sende en øjeblikkelig opdatering.

1985 var et svært år for FDA. Først brugte kongressen pres for at reducere den tid det tog for at få et lægemiddel til markedet, og de fokuserede deres opmærksomhed på regulatoren for at få dem til at gøre noget ved det. Kongressens embedsmænd blev parkeret af den magtfulde farmaceutiske lobby, og med millioner af dollars værd af potentielle kampagnebidrag på linjen handlede de hurtigt.
Samtidig blev FDA involveret i en korruptionskandale, da udbetalinger fra generiske lægemiddelvirksomheder til FDA-medarbejdere blev afdækket. Skandalen ser ud til at have kun været relateret til generiske lægemidler, og der er ingen indikation for, at henstillingen fra Dr. Maxwell blev givet i betragtning af kompensation fra en hvilken som helst part. Alligevel var det en stor rystelse i FDA’s kultur.
Gennem 1980’erne var der et stadigt stigende antal studier på mefloquine. De fleste involverede interaktionen mellem mefloquin og andre lægemidler og ville finde sted på steder rundt om i verden og med varierende antal deltagere. Igen var der nogle rapporter om alvorlige bivirkninger, der involverede psykologisk symptomologi, men undersøgelserne var overvældende støttende for mefloquin.
Forståelse af processen: kliniske forsøg
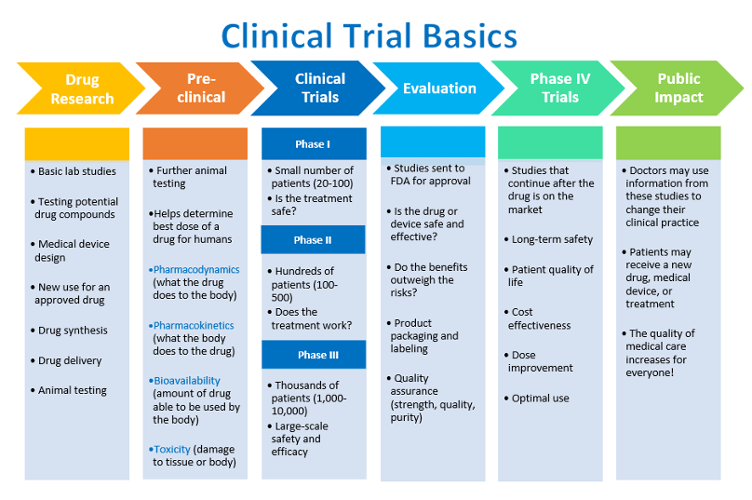
Fordi kliniske forsøg spiller en vigtig rolle i denne historie, og i den godkendelsesproces, der er involveret i den medicin du tager, tænkte jeg, at jeg ville gå igennem det for at hjælpe dig med at sætte tingene i perspektiv.
Der er ingen hurtige og hurtige regler for kliniske forsøg, intet specifikt med hensyn til det krævede antal deltagere i en undersøgelse og andre ting af denne art. Kliniske forsøg, teoretisk, er designet til at opnå det bedst mulige resultat i bedste tilfælde. Mange gange er forholdene langt fra det bedste tilfælde, især når det kommer til antallet af emner (mennesker), der er tilgængelige for at deltage i en undersøgelse.
Fase nul
Typisk er der fem faser til et klinisk forsøg, men kun fire omtales. Den første refereres til som fase zero klinisk forsøg. Disse forsøg er forskellige fra andre kliniske forsøg, idet de er sonderende undersøgelser, der bruges til at fremskynde godkendelsesprocessen for et nyt lægemiddel, og udføres normalt kun på få patienter. Mange gange er disse undersøgelsesmidler og er lavet under ekstraordinære omstændigheder.
Jeg vil redde mit selv nogle sorg og bare kopiere og forbi dette næste afsnit om menneskelige kliniske forsøg fra centerwatch.com.
Fase I
Fase I-undersøgelser vurderer sikkerheden af et lægemiddel eller en enhed. Denne indledende fase af testen, som kan tage flere måneder at fuldføre, omfatter normalt et lille antal sunde frivillige (20 til 100), som generelt betales for at deltage i undersøgelsen. Undersøgelsen er designet til at bestemme virkningerne af stoffet eller enheden på mennesker, herunder hvordan det absorberes, metaboliseres og udskilles. Denne fase undersøger også de bivirkninger, der opstår, da doseringsniveauerne øges. Ca. 70% af eksperimentelle lægemidler passerer denne fase af testningen.
Fase II
Fase II-undersøgelser tester virkningen af et lægemiddel eller en enhed. Denne anden fase af test kan vare fra flere måneder til to år, og involverer op til flere hundrede patienter. De fleste fase II-studier er randomiserede forsøg, hvor en gruppe patienter får det eksperimentelle lægemiddel, mens en anden “kontrolgruppe” modtager standardbehandling eller placebo. Ofte er disse undersøgelser “blinde”, hvilket betyder, at hverken patienterne eller forskerne ved, hvem der har modtaget det eksperimentelle stof. Dette giver efterforskere mulighed for at give lægemiddelfirmaet og FDA komparative oplysninger om den relative sikkerhed og effektivitet af det nye lægemiddel. Omkring en tredjedel af eksperimentelle lægemidler gennemfører vellykket både fase I og fase II studier.
Fase III
Fase III undersøgelser involverer randomiseret og blind test i flere hundrede til adskillige tusinde patienter. Denne omfattende test, som kan vare i flere år, giver lægemiddelfirmaet og FDA en mere grundig forståelse af effektiviteten af stoffet eller enheden, fordelene og omfanget af mulige bivirkninger. 70% til 90% af de lægemidler, der går ind i fase III-studier, gennemfører med succes denne testfase. Når fase III er afsluttet, kan et lægemiddelfirma anmode om FDA-godkendelse til markedsføring af lægemidlet.
Fase IV
Fase IV-undersøgelser, der ofte kaldes post-marketingovervågningsforsøg, udføres efter at et lægemiddel eller en enhed er godkendt til forbrugs salg. Farmaceutiske virksomheder har flere mål på dette stadium: (1) at sammenligne et lægemiddel med andre lægemidler, der allerede findes på markedet; (2) at overvåge et lægemiddels langsigtede effektivitet og indvirkning på patientens livskvalitet; og (3) at bestemme omkostningseffektiviteten af en lægemiddelbehandling i forhold til andre traditionelle og nye terapier. Fase IV-studier kan resultere i, at et lægemiddel eller en enhed tages ud af markedet, eller der kan sættes restriktioner for brugen på produktet afhængigt af resultaterne i undersøgelsen.
Det er klart, at det ville være ekstremt svært at udføre det perfekt ideelle kliniske forsøg, det er netop det, som tingene er. Denne risiko går med hvert lægemiddel på markedet, og vi tager denne risiko med hver dosis af en ny medicin. Det kommer til sidst til et spørgsmål om, hvorvidt belønningen er værd at risikoen. Nogle gange er det, og tragisk, nogle gange er det ikke.
Dette er spørgsmålet, mange ville stille efter 1989, året Lariam blev godkendt til brug i USA af Food and Drug Administration. Desværre ville mange af dem få svaret, de ikke ønskede at få.
I del 3 begynder rapporterne om bivirkninger at komme ind, og stoffet er impliceret i et mord.
J’aime me promener sur votre blog. un bel univers agréable. Blog intéressant et bien construit. Vous pouvez visiter mon blog récent. A bientôt.
LikeLike